MECANISMOS
Genes supresores:
PROTOONCOGENES
Los protoooncogenes son
genes incluidos en el genoma humano que regulan el crecimiento y la
diferenciación celular. Sus proteínas se expresan en diferentes momentos del
ciclo y son imprescindibles para su regulación. En principio, el término
protooncogén puede ser confuso, ya que implica de forma errónea que estos genes
existen con el único fin de expresar un fenotipo tumoral, cuando realmente su
función es esencial para la regulación del ciclo celular. Determinados cambios
estructurales y/o funcionales en los protooncogenes contribuyen a la
malignización de la estirpe celular, convirtiéndolos en oncogenes. Estos
oncogenes originarán proteínas con expresión/función alterada que favorecerán
el crecimiento y/o la invasividad tumoral.
La investigación de
estos genes, ha ido asociada a los avances que se han realizado en biología
molecular sobre los genes transformantes de los virus. De esta manera se
descubrió la relación entre el virus del papiloma humano y cáncer de cérvix,
VHB y cáncer hepático, o VEB y linfoma de Burkitt y el carcinoma nasofaríngeo,
entre otros.
Los oncogenes sólo
precisan estar mutados en un alelo, para que se produzca la sobreexpresión de
una proteína dada y esta ejerza su acción promotora.
El paso/activación de
protooncogén a oncogén se puede producir por diferentes mecanismos:
- Translocación: cuando una parte de un cromosoma se liga a
otro. El resultado es un híbrido de cromosoma, detectable en el cariotipo. Esto
da lugar a una alteración en la transcripción del DNA.
- Mutaciones puntuales: sustitución de un par de bases por otro par
en una secuencia de
DNA, por ejemplo G:C
por A:T.
- Amplificación: las células eucariotas están formadas por un genoma diploide, es decir,
tienen dos copias de cada gen. En determinadas circunstancias una de las copias
puede multiplicarse miles de veces, aumentando su tasa de expresión, dando
lugar a la amplificación del gen. Es uno de los mecanismos más habitualmente
implicados en la carcinogénesis.
- Mutagénesis por inserción: producida por la inserción del ADN del virus en el genoma
del huésped.
Entre los virus que
pueden provocar mutaciones que lleven al cáncer, podemos distinguir entre
los pertenecientes al
grupo de los retrovirus y los pertenecientes al grupo de los ADN-virus.
En una infección
retroviral, el virus se integra en el cromosoma de la célula infectada, previa
conversión de su ARN en cadena doble de DNA en el citoplasma. Este provirus
puede insertase en el genoma cerca de un protooncogén. Cuando ahora el virus se
reproduce, el protooncogén (o
parte de él) puede
incorporarse en el genoma viral. Tras ciclos repetidos de infección viral y
reproducción, el protooncogén que porta puede mutar y/o reordenarse en el
genoma, de tal manera que se convierte en oncogén. Algunos ejemplos de estos
virus son los virus de laleucemia humana 1 y 2 (HTLV-1 y HTLV-2).
En cuanto a los
ADN-virus, Se integran en el genoma del huésped de forma permanente. Pueden
expresar de esta manera genes como E1A y E1B que inactivan p53 y pRB y también
estimular la ciclina A y E. Algunos ejemplos son el Ag E1A de los adenovirus,
el Ag T del SV-40, y la proteína E6 en el HPV. Se han constatado tres tipos de
virus con importancia oncogénica clínica:
- Los herpesvirus, como
el virus de Ebstein-Barr en relación con linfoma Burkitt y el carcinoma nasofaríngeo,
- Los hepadnavirus,
como el virus de la hepatitis B en relación con el hepatocarcinoma 5
- Los papilomavirus (HPV) en relación con el carcinoma de cervix , anorrectales, esófago y piel.
ONCOGENES
De bueno a
malo: ¿Cómo un Protooncogenes se convierte en Oncogenes?
En la actualidad, se
conocen más de 40 diferentes proto-oncogenes humanos. Pero, ¿qué tipos de
mutaciones convierten estos proto-oncogenes en oncogenes? La respuesta es
sencilla: Los oncogenes surgen como resultado de mutaciones que aumentan el
nivel de expresión o actividad de un proto-oncogén. Mecanismos genéticos
subyacentes asociados con la activación de oncogenes incluyen los siguientes:
·
Las mutaciones puntuales, deleciones, o inserciones que conducen a un
producto génico hiperactivo .
·
Las mutaciones puntuales, deleciones, o inserciones en la región
promotora de un proto-oncogén que conducen a un aumento de la transcripción .
·
Eventos de amplificación de genes que conducen a copias cromosómicas
adicionales de un proto-oncogén .
·
Eventos de translocación cromosómica que se trasladan de un proto-oncogén
a un nuevo sitio cromosómico que conduce a una mayor expresión.
·
Translocaciones cromosómicas que dan lugar a una fusión entre un
proto-oncogén y un segundo gen, que produce una proteína de fusión con
actividad oncogénica.
ROL DE LOS ONCOGENES EN EL DESARROLLO DE TUMORES
La activación de un oncogén puede contribuir al
desarrollo de cáncer de 2 maneras:
A)-ACTIVACIÓN DE LOS PROCESOS DE PROLIFERACIÓN
CELULAR
Recordemos brevemente que la vida de una célula
se inicia con su formación a partir de una célula madre y termina con la
formación de sus células hijas o bien con su muerte. Las etapas a través de las
cuales pasa la célula de una división a la siguiente constituye el ciclo
celular. Este ciclo se divide básicamente en dos tiempos: la mitosis (Fase M) y
la interfase (Fases G1 –metabolismo y crecimiento, transcripción-, S
–replicación- y G2 –crecimiento y transcripción-)
Los pasajes de G1 a S y de G2 a M constituyen
momentos en que se verifica si están dadas las condiciones adecuadas para
progresar en el ciclo, esto es lo que se denomina: Puntos de Control, Puntos de
Verificación o Checkpoint. En caso de no darse las condiciones adecuadas, el
progreso del ciclo es detenido para reparar los daños sufridos por la célula en
la etapa anterior. Estas condiciones adecuadas tienen que ver por ejemplo con:
la disponibilidad de nutrientes, la integridad del ADN, la actividad de los factores
de crecimiento y el funcionamiento de las vías metabólicas. Recordemos también
que el pasaje de G1/S y G2/M involucran la fosforilación de Quinasas
dependientes de Ciclinas (cdk) –ej: cdk2 en G1/S y cdk1 en G2M- por Ciclinas.
Las Ciclinas –ej: Ciclina E en G1/S y Ciclina B o A en G2/M- constituyen las
subunidades reguladoras de serintreoninquinasas llamadas genéricamente Factores
Promotores de la Mitosis (FPM) A su vez las cdks fosforilan proteínas que serán
útiles para el progreso del ciclo celular. Por ejemplo: en el paso G2/M se
sintetiza p54, quinasa que fosforila a la ciclina M y esta a su vez a las cdkM.
Esta cdkM fosforila varias proteínas como las Histonas H1, lamininas,
nucleolina y la miosinquinasa, todas participantes en la mitosis o en la
citoquinesis. Además, las cdks son controladas por proteínas inhibidoras. Estos
inhibidores de las cdks constituyen una familia proteica llamada: Familia de la
Proteína Inhibidora de Kinasa (KIP) Esta familia está compuesta por: p21, p27 y
p57 y la familia inhibidora de cdk4 (CIN4) Estos genes pueden sufrir mutaciones
que contribuyan a la transformación maligna por interferir en el control de
ciclo celular.
La activación o represión de la síntesis de
ciclinas dependerá de cascadas de activación covalente que transducen señales
externas para inducir proliferación. Así que los protooncogenes codificantes
para proteínas que intervienen en cualquier nivel en esta cascada regulatoria
al ser activados en oncogenes podrían participar en la transformación maligna
por medio de la activación descontrolada de la proliferación celular.
Por ejemplo: Factores de crecimiento como el
Factor de crecimiento derivado de plaquetas (PDGF), subunidades de receptores
para factores de crecimiento como el receptor para el factor de crecimiento
epidermoide (EGFRc), moléculas transductoras de señal (Ras, ABL), factores de
transcripción que activan la síntesis de ciclina por interacción directa con el
ADN como Myc, Fos y Jun y las propias ciclinas. En cualquiera de los casos, el
producto de oncogén contribuye a la transformación maligna por dos mecanismos:
avance del ciclo celular en forma descontrolada y evasión de los puntos de
control de modo que no hay tiempo para reparar alteraciones en la célula
acumulando daños sobre el ADN.
En el caso del oncogén c-myc en
particular, éste producto se halla ausente en células quiescentes (G0) y se
expresa cuando el ciclo comenzará a progresar en G1, hallándose en grandes
cantidades en G1/S. Su expresión se sostiene mientras la célula siga ciclando.
Existen tumores en que este oncogén se halla amplificado o redispuesto como en
el linfoma de Burkitt, y se expresa anormalmente en forma permanente.
B)-BLOQUEO DE LOS PROCESOS DE SENESCENCIA Y
MUERTE CELULAR
Para morir las células entran en el proceso de
APOPTOSIS, también llamada MUERTE CELULAR PROGRAMADA. Este proceso involucra el
desemblaje controlado de una célula sin que ello afecte a sus células vecinas
ni al organismo en general. Cuando una célula muere en apoptosis no hay proceso
inflamatorio activado en el área circundante. Cuando por alguna razón la célula
no responde a controles y resiste ingresar en esta vía se alteran los procesos
fisiológicos del entorno celular, como en el caso de las células cancerosas.
Las células apoptóticas sufren cambios característicos como la alteración de la
composición lipídica de la cara externa de la membrana plasmática que
posteriormente englobará restos celulares envueltos por membrana que se
denominan cuerpos apoptóticos.
El proceso ordenado de muerte celular por
apoptosis es caracterizado por diversas fases:
·
Las células que
inician su muerte comienzan por perder contacto con sus células vecinas y se
desprenden del tejido.
·
Condensación del
núcleo y de la cromatina.
·
Condensación del
citoplasma con marcada reducción del volumen celular.
·
Las mitocondrias
liberan citocromo c al citoplasma y pierden potencial de membrana.
·
Fragmentación
internucleosomal del ADN por parte de endonucleasas dependiente de Mg2+.
Burbujeo de la membrana celular y vesicularización del contenido celular
(cuerpos apoptóticos)
·
Señalización a
células vecinas y atracción de fagocitos.
La cascada de eventos que resulta en la
activación de la muerte celular es bastante compleja y puede ser desencadenada
por varios estímulos. Estos se han divido de acuerdo a su naturaleza en tres
grupos:
·
Químicos:
Actualmente se conoce que la forma en que actúan varias drogas usadas en el
tratamiento del cáncer (quimioterapia) es estimulando apoptosis. Muchas de
ellas inducen daño a nivel del ADN activando así la síntesis de algunas
proteínas promotoras de apoptosis.
·
Físicos:
Radiaciones ionizantes, radiaciones ultra violeta, etc. Son estímulos comunes
en la activación de apoptosis. El daño provocado por la radiación o el estrés
oxidativo sobre el ADN es detectado en los puntos de control del ciclo, éste se
detiene y cuando la reparación no es suficiente para sostener la homeostasis,
la célula es dirigida a la apoptosis.
·
Biológicos:
Receptores en la superficie celular, tales como los miembros de la superfamilia
del Factor de Necrosis Tumoral (TNFR, Fas (CD95/Apo1), TRAIL, etc.) al unirse a
sus ligandos naturales, son capaces de desencadenar muerte celular programada.
Esos ligandos, en general, son liberados por células del sistema inmune y están
destinados a eliminar células alteradas a consecuencia de infección o injuria
así como células viejas o que manifiesten características anormales. La
activación de receptores de muerte es también el modo de seleccionar las
poblaciones celulares que van a sobrevivir en el desarrollo y la diferenciación
de las diferentes líneas. La compleja cascada de eventos mediada por estos
receptores está rigurosamente controlada.
Diversas son las señales que pueden inducir la
apoptosis en una célula: alteraciones del metabolismo, producción de radicales
libres o activación se señales de muerte mediadas por receptor. La progresión
de la muerte está mediada por un grupo de enzimas llamadas genéricamente
CASPASAS (de: Proteasas Citosólicas Específicas de Aspartato). Éstas se hallan
como proenzimas que se activan por clivaje proteolítico. Las más importantes
son: Caspasa 8 que inicia el proceso en respuesta a ligandos extracelulares por
su activación asociada en complejos proteicos con receptores portadores de
dominios de muerte y Caspasa 9 que se activa por injurias que liberan Citocromo
C desde la mitocondria. Cualquiera sea el mecanismo de inicio, se activa por
clivaje a partir de una de éstas la Caspasa 3. La caspasa 3 cliva a su vez
proteínas vitales para la célula y caspasas adicionales que amplifican el
proceso de muerte.
Existen dos vías centrales de inducción de
apoptosis:
1- La unión de un ligando extracelular a un
receptor en la membrana plasmática. Como en el caso de citoquinas (Factor de
Necrosis Tumoral –TNF- α o β o Fas ligando) También por la unión de un ligando
extracelular puede inducirse la activación a las caspasas a través de
modificaciones en el receptor de Interleuquina 1 (IL-1, cuya señal normal es
proliferativa)
2- La liberación de Citocromo C por alteración en
el potencial de membrana de la mitocondria a causa de un desequilibrio severo
en el metabolismo celular. Esto habitualmente suele acompañarse del incremento
de los niveles de Calcio intracelular. Esta última vía de inducción de
apoptosis se halla regulada por una familia de proteínas diméricas de la
membrana mitocondrial interna conocidas como proteínas BCL. Algunas de éstas
como Bad y Bax cuando se encuentran en cantidades mayores a la normal producen
un bloqueo de la fase M (“Arresto Mitótico”) que detiene el ciclo y si se
mantiene en el tiempo desencadena la alteración del potencial de membrana
mitocondrial y la activación de caspasas. Otras como BCL 2 y BCL X son
inhibidoras de la apoptosis favoreciendo la progresión del ciclo celular. La
tasa de expresión de estas proteínas depende de las condiciones en que se
encuentra la célula (metabolismo, disponibilidad de nutrientes, etc.)
Algunos de los genes codificantes para las
proteínas que intervienen en la activación de cualquiera de las dos vías de
inducción de apoptosis son protooncogenes. Entre ellos encontramos: una de las
subunidades del receptor para el TNFβ, una de las subunidades del Receptor para
IL-1 y a los productos de la familia de genes bcl.
La complicada maquinaria compuesta de factores
pro y antiapoptóticos es necesaria para los organismos multicelulares como
salvaguarda para prevenir disparadores erróneos de muerte o proliferación. Los
efectos balanceados de estos factores en los diferentes puntos de control de
transducción de señales culminan en la decisión final de vivir o morir. El
colapso de este balance lleva a una variedad de enfermedades, entre ellas el
cáncer.
MECANISMOS DE ACTIVACIÓN DE ONCOGENES
Una mutación es básicamente la alteración de la
estructura en el ADN involucrando esto el cambio de una o más bases en la
secuencia de nucleótidos, conllevando la alteración de uno o más codones. A
diario se producen mutaciones que pueden ser reparadas por las enzimas del
mecanismo de reparación del ADN. Si no alcanzan a ser reparadas el genotipo mutado
puede o no traducirse fenotípicamente, es decir, que una mutación puede
expresarse como alteración en la estructura de la proteína para la que el gen
afectado codifica o bien puede no alterar la proteína, en este caso se trata de
una mutación silenciosa. A su vez estas mutaciones pueden ser clasificadas en:
CROMOSÓMICAS (Anomalías de Número como las Trisomías y Monosomías Anormalía
Esctructurales como Translocaciones, Supresiones e Inserciones o GÉNICAS
(Mutaciones puntuales como Transiciones y Transversiones y Mutaciones en la
pauta de lectura como Inserciones y Delecciones) dependiendo de la cantidad y
nivel estructural del ADN afectado.
La activación de un oncogén es el resultado de
una o varias mutaciones en un protooncogén que alteran estructural y
funcionalmente a su producto.
A nivel génico:
·
El gen puede sufrir
mutaciones que afecten los exones de modo que se altera la estructura de sus
productos y con ello su actividad biológica (proteínas truncadas, proteínas mal
plegadas, etc)
·
Una mutación puede
ocurrir sobre enhancers cercanos a la región del promotor de modo que el
producto normal se expresa en cantidades anormalmente bajas o anormalmente
altas.
A nivel cromosómico:
Puede ocurrir una redisposición del cromosoma que
lleve una secuencia de ADN desde una porción normalmente muy distante a un
sitio próximo al oncogén pudiendo afectar su tasa de expresión o la pauta de
lectura. O bien se produzcan supresiones o recombinaciones anormales con
traslocación.
La activación del oncogén puede ser resultado de
una o varias mutaciones en otros genes que alteran la tasa de expresión de un
protooncogén aún cuando el producto sea estructural y funcionalmente normal
Estas mutaciones pueden ser causadas por agentes físicos, químicos o
biológicos. Los agentes que inducen mutación sobre el ADN se llaman MUTÁGENOS.
Cuando estas mutaciones conllevan oncogénesis y transformación maligna hablamos
de CARCINÓGENOS. Todos los carcinógenos son mutágenos pero no todos los mutágenos
son carcinógenos.
AGENTES FÍSICOS: las radiaciones UV, ionizantes (y rayos X dañan al
ADN de diversas maneras. La radiación UV puede generar dímeros de timina.
Pueden también formarse sitios apurínicos o apirimidínicos por eliminación de
bases. Puede romperse la cadena de nucleótidos o formarse puentes cruzados
entre ellas. En el caso de los rayos X y las radiaciones ionizantes éstos
pueden generar radicales libres intracelulares provocando estrés oxidativo
potenciándose el efecto mutagénico.
AGENTES QUIMICOS
|
COMPUESTOS
|
Hidrocarburos policíclicos aromáticos
(Intercaladores)
|
Benzopireno, Dimetilbenzoantraceno, PCB,
Dietiletilbestrol
|
Aminas Aromáticas
|
MAV
|
Nitrosaminas
|
Dimetilnitrosamina, Dietilnitrosamina
|
Compuestos Naturales
|
Dactinomicina, Aflatoxina B1
|
Alquilantes
|
Ciclofosfamida, Cisplatino
|
Compuestos Inorgánicos
|
Arsénico, Asbesto, Berilio, Cadmio,
Cromo
|
AGENTES QUÍMICOS: Los carcinógenos químicos pueden actuar en dos
formas. Pueden, por sí mismos, interaccionar con el ADN (CARCINÓGENOS DIRECTOS)
o bien, necesitar una modificación previa catalizada por enzimas del propio
organismo (PROCARCINÓGENOS) En el caso de estos últimos el proceso por el cual
se vuelven capaces de producir mutaciones se llama ACTIVACION METABÓLICA, los
intermediarios formados en este proceso se llaman CARCINÓGENOS INMEDIATOS y el
producto que reacciona con el ADN se llama CARCINÓGENO FINAL o CARCINÓGENO
ESENCIAL. Las enzimas responsables de la activación metabólica están
relacionadas al citocromo P450, con utilización de NADPH y habitualmente
participan en la eliminación de sustancias tóxicas y fármacos del organismo.
Los agentes químicos provocan daño al ADN por varios mecanismos según su
estructura.
Existe otro grupo de compuestos químicos llamados en general:
PROMOTORES DE TUMOR. Éstos no son mutágenos y no producen tumores por sí solos.
Su acción altera la regulación de la expresión genética y estimula la división
celular potenciando a los carcinógenos. Este es el caso de los ésteres de
forbol y la sacarina. Al mutágeno que interacciona con un promotor de tumor en
general se lo llama INICIADOR. La iniciación del tumor generalmente es rápida e
irreversible, la promoción en cambio es lenta (desde meses hasta años)
Por último se conocen también sustancias químicas que si bien no
actúan directamente sobre el ADN son responsables de alterar la biología de la
célula o la interacción con su entorno. A esta alteración del medio, la célula
responde provocando mutaciones en su ADN que pueden llevar a transformación
maligna, este un mecanismo por cambios epigenéticos. Un gran número de
sustancias químicas, como contaminantes ambientales, de las que hasta hace poco
no se conocía que eran cancerígenos actúan de esta manera.
Hay una gran variación en la ocurrencia y los tipos de cáncer hallados
en todo el mundo. Cuando la gente emigra a un nuevo lugar en general adquiere
el perfil de ocurrencia de cáncer de su nuevo hogar en una generación. Además,
la incidencia de cáncer en determinadas profesiones es más alta que en otras.
Esto prueba que los factores ambientales especialmente los químicos
contaminantes son de gran importancia en la patogénesis de las transformaciones
malignas.
AGENTES BIOLÓGICOS: Algunos virus son capaces de producir
transformación maligna.
·
Virus DNA: todavía
no se sabe a ciencia cierta cómo actúan. Algunos portan secuencias de oncogenes
virales que toman el comando en la célula huésped modificando su proliferación
y muerte. Otro mecanismo propuesto y aceptado es que las proteínas virales se
unan a genes supresores de tumor impidiendo su acción normal. Son ejemplos: el
virus de Epstein Barr, el virus B de la hepatitis, y dos cepas de papilomavirus
humanos. En todos los casos estos virus son causantes de enfermedades benignas
luego de las que algunos casos evolucionan posteriormente a la formación de tumores.
Esto sugiere que la infección viral es sólo uno de los pasos en la
transformación maligna.
·
Virus RNA: En
enfermedad humana son dos los retrovirus relacionados a transformación maligna
y en ambos casos son de baja incidencia. El HTLV-1 virus causante de leucemia
humana a células T del adulto y el HIV (virus de inmunodeficiencia humana).
Este último en realidad no se ha asociado directamente a transformación maligna
sino que favorece el desarrollo de tumores por la inmunosupresión. Los tumores
habitualmente asociados al HIV son el sarcoma de Kaposi y los linfomas aunque
es amplia la variedad de tumores que pueden presentarse en estos pacientes.
Si el virus DNA porta en su genoma una secuencia de oncogén viral no
es necesario que se inserte en un sitio especial del genoma para provocar la
transformación maligna. Cuando el virus DNA o RNA no porta un oncogén viral,
dependiendo del sitio de inserción del ADN viral que se integra al genoma del
huésped pueden presentarse dos casos que constituyen lo que se llama:
MUTAGÉNESIS POR INSERCIÓN:
INSERCIÓN PROMOTORA: cuando la inserción del ADN viral se produce
cercana a la región del promotor o corriente arriba del sitio de inicio de
transcripción de un protooncogén de modo que este se activa y el oncogén celular
comienza a transcribirse en forma descontrolada.
INSERCIÓN FACILITADORA: cuando el ADN del virus se inserta corriente
debajo del sitio de iniciación del protooncogén y actúa como un enhancer
corriente abajo.
Cualquiera sea la causa encontraremos los siguientes mecanismos de
activación de oncogenes:
1- Mutagénesis por inserción: descripta en el ítem anterior.
2- Traslocaciones cromosómicas: cuando parte de un cromosoma se
liga con otro. Esta translocación puede afectar la estructura de un
protooncogén y determinar su activación. Este es el caso del cromosoma
Filadelfia (de la leucemia mieloide crónica) en que se produce una traslocación
9,22 originando un oncogén codificante para una proteína de fusión quimérica
(BCR-ABL) con actividad descontrolada de tirosin quinasa. Otro ejemplo es la
translocación 8,14 que activa en forma permanente al oncogén c-myc en
linfocitos originando el Linfoma de Burkitt.
3- Amplificación Génica: Un gran
número de tumores cursa con la amplificación (es decir la repetición de secuencias)
de oncogenes presentes en un número de copias mucho mayor al normal, lo que
aumenta su tasa de expresión.
4- Mutaciones Puntuales: Se conocen muchos casos en que
mutaciones puntuales determinan la síntesis de proteínas productos de oncogén
que pierden su capacidad de ser reguladas y permanecen activas o inactivas sin
responder a controles, lo que altera los procesos normales de proliferación y
muerte de las células. Las mutaciones son también el mecanismo por el que genes
supresores de tumores y otros genes contribuyen a la transformación maligna.
Son los genes que reducen la probabilidad
de que una célula normal mute o se transforme a una célula cancerígena,
inhibiendo su proliferación excesiva por medio de una proteína llamada “proteína supresora de tumores”, por
lo que también puede recibir el nombre de antioncogen.
La activación de oncogenes no constituye
la única vía hacia la malignidad. En la gran mayoría de los cánceres la
transformación maligna es resultado de la combinación de la activación de
oncogenes y la anormal inactivación de GST.
Los GST son también genes de clase II
cuyos productos poseen actividad fisiológica que influencia el progreso del
ciclo celular y la inducción de Apoptosis. A diferencia de los protooncogenes,
los GST son activadores de procesos apoptóticos o bloqueantes del progreso del
ciclo celular. Los mecanismos por los cuales la expresión genética de los GST
puede alterarse son similares a los de activación de oncogenes, y es válido
para éstos todo lo descripto anteriormente. Casi todos los tipos de cáncer humano
parecen acompañarse de la pérdida o mutación de uno o más GST. Algunos incluso
parecen ser causales de tipos específicos de tumores mientras que otros se
hallan presentes en una amplia gama de cánceres.
En todos los casos, la alteración de los
GST se manifiesta con carácter recesivo, es decir se necesita la alteración de
ambos alelos del gen en cuestión para provocar una alteración fenotípica que
comprometa la fisiología de la célula. Por otro lado, la alteración puede ser
heredada en línea germinal. Esto explica en gran parte el carácter hereditario
de algunos cánceres cuya frecuencia es alta en determinadas familias (formas
hereditarias) y que se presentan raras veces en la población general (formas
esporádicas) En las formas hereditarias inicialmente uno de los alelos está
dañado desde la línea germinal y el restante puede sufrir una mutación por
cualquiera de las causas antes descriptas y expresarse la alteración. En las
formas esporádicas se necesita alterar los dos alelos en una misma célula por estos
mecanismos, lo que por azar es bastante difícil y estas formas son raras.
Existen más de 17 genes supresores de
tumores causantes de cáncer humano. Los
que mejor identificados se encuentran son los que codifican para la proteína
P53 y RB.
Genes para proteínas en el citoplasma:
APC: Las personas que nacen con
mutaciones en un alelo de este gen desarrollan pólipos de colon y cáncer de
estómago. La APC en condiciones normales se une en el citoplasma a la β-catenina,
a la que degrada, por lo que en su ausencia la β-catenina aumenta y pasa al
núcleo estimulando así la proliferación celular.
DPC4: Para cáncer de páncreas.
NF-1: Codifica para una proteína que
inhibe una proteína estimulante. Causa
cáncer del sistema nervioso periférico y leucemia mieloide.
NF-2: Para meningiomas y ependinomas, también afecta las
vainas de mielina.(3)
Genes para proteínas en el núcleo:
MTS1: Codifica para la proteína p16, involucrado en una amplia variedad de cánceres. (3)
RB: Codifica para pRB que es una proteína encargada del control del
ciclo celular, por lo que puede causar retinoblastomas y cáncer en huesos,
vejiga, pulmón y mamas.
P53: Codifica para la proteína p 53 que
está encargada de la apoptosis celular, por lo que se involucra en una gran
variedad de cánceres.
WT1: Tumor de Wilm en el riñón.
Genes
para proteínas sin localización clara:
BRCA1: Cáncer de mama y ovario.
BRCA2: Cáncer de mama.
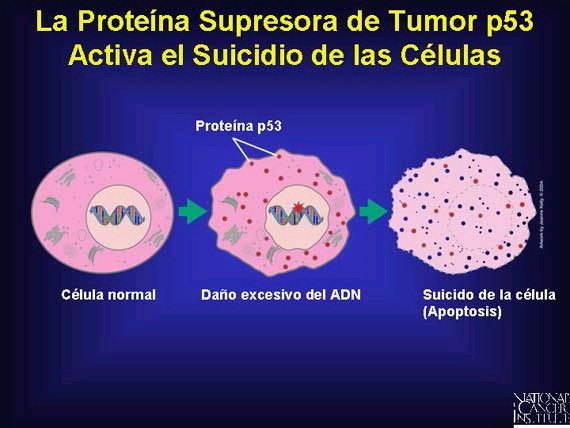
P53: Es el encargado de sintetizar la p53, la cual es activada al
momento de la división celular y así poder controlar que se realice
correctamente. Al momento de detectar
daños en el material genético de la célula, esta proteína intenta repararla,
pero si el daño es irreparable estimula la apoptosis celular. Al momento de que
este gen sufra una mutación, el mecanismo de apoptosis se verá alterado y el
material genético dañado no podrá ser reparado, de esta manera es como comienza
el tumor.
Otra causa por la que se pueden crear los
tumores, y que no es por causa de una mutación genética, es por los virus como
el papiloma humano que presenta la proteína E6, esta se une a la p53 y la
degrada por medio de la ubiquitina.
RB: Este actúa en la primera parte de la
fase G1 del ciclo celular. La RB se une a factor de transcripción E2F y el
complejo resultante de esta unión tiene dos funciones: cuando el RB se une al
E2F no permite que el E2F realice su función normal que ayuda a iniciar la fase
S, por lo que no se puede comenzar; la segunda función es la de reprimir la
transcripción de otros genes. Esta unión de RB-E2F puede desencadenar un
retinoblastoma.
NF1: Este atrapa a la proteína Ras antes
de que produzca sus directivas promotoras del crecimiento. Se relaciona con
leucemia mieloide, y cáncer del SNP.
GEN SUPRESOR
|
FUNCIÓN
|
SÍNDROME
|
TUMORES ASOCIADOS
|
Rb1
|
Regula el ciclo celular
|
Retinoblastoma
|
Retinoblastoma, osteosarcoma
|
P53
|
Detiene el ciclo y causa
apoptosis en respuesta a ADN dañado
|
Li- Fraumeni
|
Sarcoma, cáncer de mama,
gliomas
|
APC/β-CATENINA
|
Inhibe la transducción de las
señales
|
Poliposis adenomatosa
familiar
|
Adenoma y adenocarcinoma de colon
|
WT-1
|
Encargado de transcripción
celular
|
Tumor de Wilms
|
Nefroblastoma
|
NF-1
|
Inhibe la transducción de la señal
RAS y del inhibidor del ciclo celular p21
|
Neurofiblomatosis tipo 1
|
Neurofibromas, sarcoas, gliomas
|
NF-2
|
Genera la estabilidad
citoesquelética
|
Neurofibromatosis tipo 2
|
Schwanomas, meningiomas
|
BRCA-1
|
Repara el ADN
|
Cáncer de mama
|
Cáncer de mama
|
BRCA-2
|
Repara el ADN
|
Familiar
|
|
P16/INK 4ª
|
Regula el ciclo celular a través de
inhibir las cinasas dependientes de ciclina.
|
Melanoma familiar, cáncer
pancreático
|
Melanoma, cáncer de páncreas
|
En
el diagnóstico y en la terapia:
La radioterapia puede llegar a ser muy
toxica para el paciente ya que no solo elimina las células cancerígenas sino
que también daña células normales. El éxito de un tratamiento eficaz es el
hecho de lograr matar selectivamente las células que están causando el daño y
produciendo los tumores, sin dañar las células que se encuentran en buen
estado. Es por esto que debemos conocer las células tumorales para lograr
restaurar los genes dañados, inhibiendo los oncogenes y de esta forma restaurar
el ciclo de la célula.
La administración de versiones sanas de
alelos del gen que codifica a la p53 y RB, en personas que hayan perdido ambos
alelos, puede restablecer su funcionamiento adecuado y de esta manera podría
restaurar su proliferación de células normales.
Bibliografías:
·
Brandan, Juaristi,
Aguirre, Romero. ONCOGENES Y GENES SUPRESORES DE TUMORES. Argentina. 2002
·
Lic. Ríos Hernández
M, Lic. Hernández Menéndez M. LOS GENES SUPRESORES DE TUMORES Y EL CÁNCER. Instituto Nacional de Oncología y
Radiobiología. Cuba 2001 pag. 65-70
·
http://amglez.webs.ull.es/Protooncogenes,%20Oncogenes%20y%20Genes%20supresores%20de%20Tumor.pdf
·
Universidad
Nacional del Nordeste, Facultad de
Medicina, Cátedra de Bioquímica; ONCOGENES
Y GENES SUPRESORES DE TUMORES; Disponible en http://med.unne.edu.ar/catedras/bioquimica/pdf/oncogenes.pdf
Categories:

















0 comentarios:
Publicar un comentario